Radioterapia raka płuca
W tej zakładce znajdują się informacje na temat leczenia raka płuca za pomocą promieniowania jonizującego. Warto przypomnieć, że głównym celem radioterapii jest zniszczenie komórek nowotworowych z możliwie jak największym zaoszczędzeniem zdrowych struktur znajdujących się w sąsiedztwie guza. Więcej ogólnych informacji na temat radioterapii znajduje się w zakładce Co to jest radioterapia?
Najczęściej radioterapię płuc podaje się 5 dni w tygodniu przez okres od 5 do 7 tygodni. Może się to różnić w zależności od rodzaju teleradioterapii i powodu jej podania. Aktualnie stosowane techniki teleradioterapii pomagają lekarzom dokładniej leczyć raka płuc, jednocześnie zmniejszając narażenie na promieniowanie pobliskich zdrowych tkanek.
Istnieją sytuacje, kiedy z powodu święta państwowego czy serwisu technicznego sprzętu radioterapia się nie odbędzie. Lekarz prowadzący za każdym razem będzie poinformowany o takiej sytuacji. Ominięcie podania jednej frakcji radioterapii wydłuży czas trwania radioterapii o jeden dzień. Ważne jest, aby nie opuszczać żadnego dnia radioterapii, chyba że jest to uzasadnione względami medycznymi pacjenta.
Techniki radioterapii stosowane w leczeniu raka płuca
Droga pacjenta do radioterapii raka płuca
Omówienie ścieżki leczenia i zgoda na leczenie radioterapeutyczne.
Przed rozpoczęciem leczenia lekarz prowadzący omawia z pacjentem plan leczenia oraz możliwe działania niepożądane terapii. Leczenie radioterapeutyczne jest w pełni refundowane, a ostateczną zgodę na terapię za pomocą promieni podejmuje pacjent po dokładnym wyjaśnieniu zasad leczenia, jego skuteczności i możliwych działań ubocznych. Warunkiem przeprowadzenia radioterapii jest pisemna zgoda chorego na zaproponowane leczenie.
Radioterapia stereotaktyczna ciała (SBRT), znana również jako stereotaktyczna radioterapia ablacyjna (SABR), jest najczęściej stosowana w leczeniu raka płuca we wczesnym stadium, gdy operacja nie jest możliwa ze względu na stan zdrowia pacjenta lub gdy pacjent nie wyraża zgody na operację. Warunkiem zastosowania SBRT jest niewystępowanie zmian przerzutowych w węzłach chłonnych klatki piersiowej, co musi być potwierdzone badaniami tomografii komputerowej (TK) i pozytonowej tomografii emisyjnej (PET). SBRT ma również zastosowanie w przypadku pojedynczych guzów przerzutowych zarówno w płucach, jak i takich narządach jak mózg lub nadnercza.
Brachyterapia to metoda, która polega na zastosowaniu izotopów promieniotwórczych umieszczanych bezpośrednio w płucu. Brachyterapia jest stosowana jako leczenie samodzielne o charakterze paliatywnym lub bardzo rzadko jako skojarzona metoda leczenia z teleradioterapią. Wybór postępowania zależy od zaawansowania choroby i od wielospecjalistycznej decyzji lekarskiej. W przypadkach występowania duszności lub krwioplucia spowodowanego guzem znajdującym się w oskrzelu, u chorych niekwalifikujących się do leczenia radykalnego metoda ta pozwala na uzyskanie szybkiego efektu paliatywnego w postaci ustąpienia wymienionych objawów.
Zabieg założenia aplikatora do brachyterapii nie wymaga znieczulenia ogólnego. Aplikator wprowadzony jest przez kanał bronchoskopu, który jest zakładany przez nos do płuc i umieszczany w okolicy guza nowotworowego. Właściwe leczenie promieniowaniem przeprowadzane jest w pomieszczeniu do brachyterapii, gdzie aplikator podłączany jest do aparatu ze źródłem promieniotwórczym.
Brachyterapia jest metodą stosowaną bardzo rzadko w leczeniu raka płuca.
Profilaktyczna radioterapia mózgowia
W drobnokomórkowym raku płuca stosowane jest profilaktyczne napromienianie mózgowia (PCI). Jak wskazuje nazwa, PCI jest stosowane u chorych, u których nie stwierdzono zmian przerzutowych w mózgu, ale w przypadku tak agresywnego nowotworu, jakim jest drobnokomórkowy rak płuca, ze względu na niedostateczną penetrację leków cytostatycznych do mózgowia istnieje wysokie ryzyko przedostania się komórek nowotworowych do tego narządu i ujawnienia się zmian przerzutowych. Zastosowanie PCI zmniejsza ryzyko ujawnienia się przerzutów do mózgu, a u części chorych o korzystniejszym rokowaniu pozwala wydłużyć przeżycie. Jest ono stosowane po wstępnym leczeniu cytostatykami (4-6 kursów) u chorych, którzy odpowiadają co najmniej częściową regresją nacieku nowotworowego. U części chorych, korzystnie odpowiadających na chemioterapię, w kolejnym etapie leczenia stosowane jest uzupełniające napromienianie śródpiersia. PCI może być przeprowadzone po radioterapii na obszar śródpiersia lub w niektórych przypadkach, jako jedyne leczenie radioterapeutyczne. Leczenie trwa 2 tygodnie (10 frakcji od poniedziałku do piątku). Wskazania do PCI zostaną omówione szczegółowo w trakcie konsultacji z onkologiem radioterapeutą.
Planowanie profilaktycznego napromieniania mózgowia
Pacjent zakwalifikowany do PCI zostaje skierowany do pracowni modelarni, która znajduje się na terenie zakładu teleradioterapii. Jest to miejsce, w którym technik wykona specjalną, indywidualną maskę termoplastyczną, która służy zapewnieniu odtwarzalnego unieruchomienia głowy podczas napromieniania. Po dopasowaniu jej do krzywizn ciała w ciągu kilku minut maska staje się sztywna. Następnie, z wykonanym wcześniej unieruchomieniem, pacjent kierowany jest do pomieszczenia tomografu komputerowego (na tzw. symulację leczenia) w celu wykonania TK do planowania radioterapii.
Zespół Zakładu Teleradioterapii
W trakcie całego leczenia pacjent będzie miał kontakt z wieloma członkami zespołu Zakładu Teleradioterapii. W skład takiego wielodyscyplinarnego zespołu zajmującego się leczeniem napromienianiem raka płuca wchodzą:
- lekarz specjalista onkolog radioterapeuta,
- lekarz specjalista onkolog kliniczny,
- lekarze rezydenci w trakcie specjalizacji z radioterapii onkologicznej oraz onkologii klinicznej,
- technicy elektroradiologii,
- fizyk medyczny,
- pielęgniarka onkologiczna,
- sekretarka medyczna,
- koordynator.
Technicy elektroradiologii zajmują się ułożeniem i przygotowaniem pacjenta do planowania radioterapii oraz odtworzeniem tego ułożenia na aparacie terapeutycznym w trakcie radioterapii. Odpowiedzialni są również za obsługę specjalistycznych aparatów – przyspieszaczy liniowych, przy pomocy których napromieniani są chorzy.
Fizyk medyczny jest bardzo ważnym członkiem zespołu radioterapeutycznego, który bierze udział w planowaniu leczenia, nie ma on natomiast bezpośredniego kontaktu z pacjentem.
Należy pamiętać, że pacjent również należy do tego zespołu! Aby przeczytać o roli pacjenta zajrzyj do zakładki Radioterapia (część ogólna).
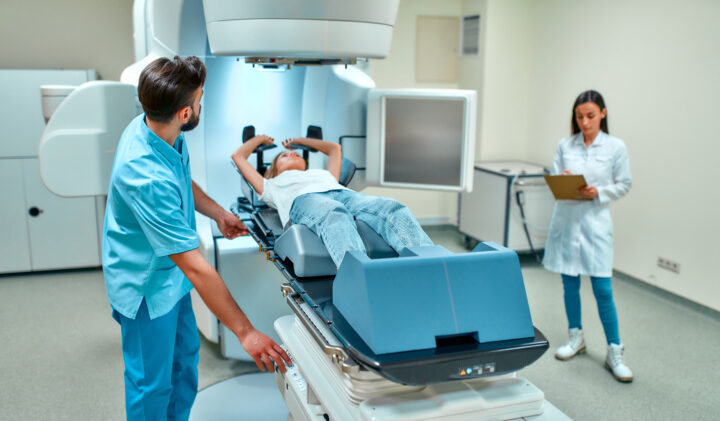
Planowanie teleradioterapii
Wyznaczenie obszaru, który należy napromieniać powinno być dokonywane na podstawie danych uzyskanych z badania tomografii komputerowej z kontrastem, badania PET-TK i innych istotnych danych klinicznych. W przypadku pacjentów, którzy otrzymywali chemioterapię indukcyjną, do planowania leczenia konieczny jest dostęp do badań obrazowych sprzed leczenia.
W trakcie konsultacji w Poradni Radioterapii (lub później w zależności od organizacji danego ośrodka onkologicznego) pacjent ma wyznaczany termin tomografii komputerowej do planowania radioterapii. W trakcie tego badania odbywa się tzw. symulacja wstępna. Tomograf komputerowy zbiera obrazy (tzw. skany) ciała pacjenta, które elektronicznie są przesyłane do komputerowego systemu planowania leczenia. Tworzony jest trójwymiarowy obraz anatomiczno-radiologiczny ciała chorego. W tym wirtualnym polu operacyjnym onkolog radioterapeuta wyznaczy obszar, który ma zostać napromieniony. Nie jest to badanie diagnostyczne. Pacjent nie otrzyma opisu badania tomografii komputerowej, służy ono jedynie do zaplanowania teleradioterapii. Podczas symulacji, wymagane jest długie leżenie w jednej pozycji.
Jeśli leżenie w bezruchu może powodować dyskomfort, przed symulacją można przyjąć leki przeciwbólowe. Trzeba to jednak skonsultować z lekarzem.
Należy włożyć wygodną odzież, którą da się łatwo zdjąć, ponieważ może zaistnieć potrzeba rozebrania się do symulacji. Nie można nosić biżuterii, ani nakładać pudrów czy balsamów.
Jeżeli pacjent nosi na skórze system ciągłego monitorowania glikemii lub pompę insulinową, zgodnie z zaleceniem producenta należy je zdjąć przed wykonaniem symulacji lub każdorazowo przed seansem radioterapii.
Przed wykonaniem symulacji wstępnej często konieczne jest dożylne podanie kontrastu. Aby można było bezpiecznie podać kontrast, pacjent powinien mieć wykonane badanie krwi sprawdzające poziom kreatyniny i wielkość parametru określanego jako GFR (wskaźnik filtracji kłębuszkowej, ang. glomerular filtration rate, określa wielkość przesączania kłębuszkowego w nerkach). Poziom kreatyniny i GFR są laboratoryjnymi obrazami funkcjonowania nerek. W związku z tym, że środki kontrastowe stosowane przy wykonywaniu tomografii komputerowej są nefrotropowe, tzn. wydalane są z organizmu przez nerki, a tym samym obciążają je, konieczne jest prawidłowe ich funkcjonowanie, a tym samym, prawidłowy wynik kreatyniny. Badanie krwi powinno być wykonane nie wcześniej niż 7 dni przed badaniem tomografii komputerowej.
Ułożenie pacjenta w trakcie symulacji wstępnej oraz podczas każdego seansu radioterapii powinno być odtwarzalne i stabilne; jest to tzw. pozycja terapeutyczna. Standardowo stosowanym ułożeniem, jest pozycja z ramionami unieruchomionymi nad głową i stabilizacją kolan. Technik elektroradiologii układa pacjenta na symulatorze. W ramach symulacji wstępnej zalecane jest wykonanie TK klatki piersiowej w dwóch fazach (z kontrastem i bez).
Podczas symulacji stół może przesuwać się. Oświetlenie sali zostanie włączone i wyłączone, a na ścianach będzie można dostrzec czerwone światła laserowe. Technicy używają świateł laserowych jako wskaźników podczas ustalania pozycji na stole pacjenta. Nie wolno patrzeć bezpośrednio w czerwoną wiązkę lasera, ponieważ może to spowodować uszkodzenie wzroku.
Technicy będą wchodzić do sali i z niej wychodzić, zawsze jednak będą prowadzić obserwacę pacjenta podczas symulacji. Technicy będą również rozmawiać między sobą podczas pozycjonowania pacjenta oraz objaśniać wykonywane czynności. Nie wolno się poruszać po rozpoczęciu symulacji, ponieważ może to zmienić ustawioną pozycję. Dyskomfort lub konieczność uzyskania pomocy należy niezwłocznie zgłosić technikom wykonującym badanie.
W czasie symulacji wstępnej często konieczne jest oznaczenie punktów na skórze pacjenta w postaci wykonania kropki barwnikiem tatuażowym (wielkości małego piega). Pielęgniarka za pomocą cienkiej igły wprowadzi niewielką ilość barwnika pod skórę. Te oznaczenia na skórze pacjenta pomagają w ustawieniu aparatu terapeutycznego, podczas każdego seansu radioterapii.
Po wykonaniu symulacji wstępnej do pracy nad planem leczenia przystępuje onkolog radioterapeuta. Wykonuje on tzw. contouring, czyli wyznaczenie obszaru, który będzie leczony promieniowaniem jonizującym. Następnie wrysowuje on wszystkie prawidłowe struktury znajdujące się w sąsiedztwie guza nowotworowego tj.: płuca, serce, przełyk, splot ramienny i rdzeń kręgowy. Dobiera odpowiednią dawkę i przekazuje taką informację do fizyka medycznego. Fizycy przy pomocy specjalistycznego komputerowego systemu planowania leczenia dobierają kształt, intensywność i kierunek wiązek promieniowania dla najlepszego dostarczenia dawki. Plan taki jest weryfikowany i zatwierdzany przez lekarza specjalistę radioterapii onkologicznej. Proces ten trwa od kilku do kilkunastu dni.
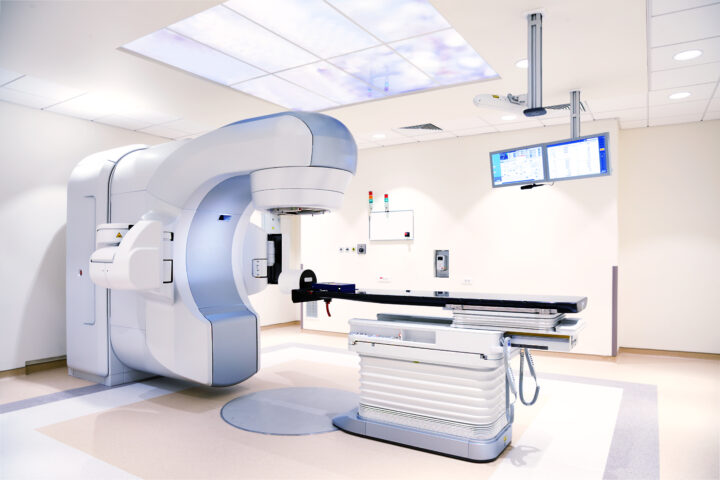
Seanse radioterapii
Radioterapia odbywa się w specjalnie przygotowanych pomieszczeniach (tzw. bunkrach terapeutycznych), w których umieszczone są przyspieszacze liniowe. Technik elektroradiologii sprawdza tożsamość pacjenta, następnie pomaga pacjentowi położyć się na stole przyspieszacza liniowego. Następnie przystępuje do ułożenia pacjenta w pozycji terapeutycznej. Pozycja ta została ustalona podczas symulacji wstępnej. Przed realizacją każdej frakcji napromieniania technik elektroradiologii wspólnie z lekarzami wykona radiologiczną weryfikację obrazową za pomocą tomografii komputerowej wiązką stożkową (CBCT). W przypadku stwierdzenia różnic konieczne jest weryfikacja planu leczenia. Proces ten zapewnia możliwie wysoką skuteczność radioterapii i pozwoli na ograniczenie ewentualnej toksyczności leczenia.
Na czas podania promieniowania technik wychodzi z pomieszczenia, w którym zostaje tylko pacjent. W trakcie seansu radioterapii należy leżeć nieruchomo. W pomieszczeniu słychać dźwięki wydawane przez aparat terapeutyczny przy ruchu głowicy. Technicy radioterapii obserwują pacjenta na ekranie i mogą się z nim komunikować za pomocą mikrofonów.
Działania niepożądane
Wczesne działania niepożądane radioterapii
Wszystkie poniżej wymienione dolegliwości ustępują zazwyczaj w ciągu 4 tygodni od zakończenia leczenia.
Odczyn skórny
Pod wpływem napromieniania, w obszarze przechodzenia wiązki terapeutycznej skóra może odpowiadać odczynem popromiennym w postaci zaczerwienienia i obrzęku, podobnym do poparzenia słonecznego. Odczynowi może towarzyszyć złuszczanie naskórka i swędzenie. Wczesny odczyn skórny najczęściej pojawia się po 2–3 tygodniach leczenia. Podrażnienie skóry ustępuje po zakończeniu radioterapii. W trakcie wizyt kontrolnych należy poinformować lekarza o wystąpieniu zmian skórnych.
Zalecenia dotyczące okolicy skóry napromienianej:
TAK:
- mycie skóry okolicy napromienianej nieperfumowanymi mydłami o neutralnym pH, najlepiej dedykowanymi do stosowania dla pacjentów będących w trakcie radioterapii, mycie ciała letnią wodą,
- używanie kremów specjalistycznych, które pomagają ograniczyć suchość, oparzenia, łuszczenie oraz świąd,
- noszenie bawełnianej, luźnej odzieży.
NIE:
- nie używać perfumowanych środków higienicznych i pielęgnacyjnych, dezodorantów,
- nie drapać skóry okolicy napromienianej, nie wystawiać okolicy napromienianej na ekspozycję na bardzo niskie i bardzo wysokie temperatury, np. nie powinno się korzystać z termoforów czy okładów z lodu,
- nie wolno pływać w basenie z chlorowaną wodą,
- nie wolno golić czy woskować skóry okolicy napromienianej.
Zmęczenie
Podczas leczenia może pojawiać się uczucie zmęczenia silniejsze niż zwykle i utrzymywać się nawet kilka tygodni po zakończeniu napromieniania. Ważne jest, aby dobrze się wysypiać i dużo odpoczywać. Nie trzeba drastycznie zmieniać swojego stylu życia. Część chorych może kontynuować pracę zawodową.
Kaszel i ból klatki piersiowej
Bardzo częstym działaniem niepożądanym radioterapii raka płuca jest kaszel. Może wystąpić zarówno kaszel wilgotny, z odkrztuszaniem śluzowej wydzieliny, jak i kaszel suchy. Zawsze należy powiadomić lekarza o wystąpieniu kaszlu, gdyż może on być objawem towarzyszącej infekcji wymagającej leczenia. W przypadku wzrostu temperatury ciała należy jak najszybciej powiadomić o tym lekarza prowadzącego. Palenie tytoniu znacznie podwyższa ryzyko wystąpienia kaszlu w czasie radioterapii.
W ciągu kilku tygodni od rozpoczęcia radioterapii może też pojawić się ból w klatce piersiowej. Jest to przewidywane działanie niepożądane leczenia promieniowaniem jonizującym, które ustąpi samoistnie. Należy jednak pamiętać, żeby o każdym takim zdarzeniu powiadomić lekarza prowadzącego, gdyż należy wykluczyć również inne możliwe przyczyny bólu w klatce piersiowej.
Popromienne zapalenie płuc
Objawy popromiennego zapalenia płuc występują u ok. 10-15% chorych napromienianych na obszar klatki piersiowej. Popromienne zapalenie płuc objawiać się może bólem w klatce piersiowej, suchym kaszlem, dusznością wysiłkową, uczuciem zmęczenia czy gorączką, bardzo rzadko wystąpić może krwioplucie. Większość chorych, u których występują zmiany popromienne w obszarze płuc, nie ma niepokojących objawów i nie wymaga leczenia.
U chorych z łagodnymi objawami popromiennego zapalenia płuc stosuje się leki wziewne, glikokortykosteroidy czy leki przeciwkaszlowe. Zalecany jest także odpoczynek, picie większej ilości płynów, stosowanie nawilżaczy powietrza, leżenie i spanie w pozycji półsiedzącej. Czasami zdarzają się jednak przypadki, kiedy przebieg popromiennego zapalenia płuc jest ciężki i wymaga hospitalizacji.
Wpływ na gardło i przełyk
Kiedy obszar napromieniany zlokalizowany jest w pobliżu gardła lub przełyku, podczas przełykania może pojawić się dyskomfort lub nawet ból. O możliwości pojawienia się takich dolegliwości pacjent usłyszy od swojego lekarza prowadzącego. Często spożywanie rozdrobnionych pokarmów, takich jak zupy, gulasze, kleiki ryżowe, czy dodanie siemienia lnianego do posiłku, pomagają złagodzić dolegliwości. Należy jednak pamiętać, aby każdy posiłek popijać letnią wodą oraz unikać spożywania bardzo gorących lub bardzo zimnych posiłków. Palenie tytoniu czy spożywanie alkoholu może dodatkowo podrażnić błonę śluzową jamy ustnej i gardła, dlatego należy unikać używek w trakcie leczenia oraz przez kilka tygodniu po jego zakończeniu. Lekarz prowadzący będzie rekomendował całkowite zaprzestanie palenia tytoniu, gdyż zwiększa ono występowanie wszystkich działań niepożądanych radioterapii, a nawet pogarsza rokowanie.
Utrata apetytu
W trakcie radioterapii pacjent może odczuwać brak apetytu, przez co może dojść do spadku masy ciała. W związku z tym ważne jest, aby starać się jeść około 5 posiłków dziennie w równych odstępach czasowych, jedzenie powinno być przeżuwane powoli i dokładnie. Zalecane jest, aby pacjent skorzystał z porady dietetyka, który doradzi, jak należy się odżywiać w trakcie trwania leczenia onkologicznego.
Nudności
Podczas terapii mogą pojawić się również nudności i wymioty, co najczęściej ma związek z chemioterapią. W trakcie wizyt kontrolnych należy poinformować o tym lekarza, który przepisze leki przeciwdziałające nudnościom.
Późne działania niepożądane radioterapii
Późne działania niepożądane radioterapii są trudne do przewidzenia. Ryzyko ich wystąpienia jest małe, zależą one od lokalizacji napromienianego obszaru. Każdorazowo lekarz omawia z pacjentem rodzaj działań niepożądanych i ryzyko ich wystąpienia, gdyż jest to bardzo indywidualna kwestia.
Skóra okolicy napromienianej może pozostać nieznacznie przebarwiona. W przeciągu kilku lat od zakończenia leczenia u niektórych chorych mogą pojawić się w tym miejscu tzw. teleangiektazje, czyli poszerzone drobne naczynia krwionośne (pajączki naczyniowe). Naczynia te położone są bezpośrednio pod skórą i przez nią prześwitują.
Utrudnione przełykanie
Radioterapia może być przyczyną zwężenia przełyku. Wtedy pojawiają się trudności
w przełykaniu pokarmu stałego oraz płynów, ból i uczucie ucisku w klatce piersiowej przy przełykaniu, krztuszenie się lub zarzucanie spożytego pokarmu z powrotem do jamy ustnej.
Jest to działanie niepożądane, które wymaga interwencji medycznej. Jeśli takie dolegliwości wystąpią w długim czasie po zakończeniu radioterapii, należy skontaktować się z lekarzem prowadzącym radioterapię.
Wpływ radioterapii na serce
Radioterapia może wpłynąć negatywnie na wydolność serca. Jest to jednak bardzo rzadkie działanie niepożądane. Ważne jest omówienie z lekarzem prowadzącym możliwość wystąpienia tego działania niepożądanego w kontekście chorób towarzyszących związanych z układem sercowo-naczyniowym.
Ważne jest również utrzymanie aktywności fizycznej na umiarkowanym poziomie zarówno w czasie leczenia, jak i po jego zakończeniu. Prowadzi to do poprawy jakości życia oraz pozwala utrzymać sprawność i wydolność wysiłkową. Aby utrzymać sprawność, warto również zaprzestać palenia tytoniu. Ma to istotne znaczenie u chorych na nowotwór płuca. Pacjenci powinni mieć zaoferowaną pomoc psychologiczną lub farmakologiczną w celu porzucenia nałogu.
Jeśli pacjent ma rozrusznik serca, przed planowanym leczeniem onkologicznym należy zgłosić się na konsultację do kardiologa. W trakcie radioterapii pacjent może przyjmować większość leków używanych wcześniej z powodu innych chorób. Ważne jest, aby listę wszystkich stosowanych preparatów przekazać lekarzowi prowadzącemu.
Po zakończonym leczeniu onkologicznym pacjent pozostaje pod opieką poradni onkologicznej, tak żeby wszystkie działania niepożądane zostały w odpowiednim momencie zdiagnozowane i ocenione przez onkologa radioterapeutę. U części chorych, zwłaszcza obciążonych przewlekłymi chorobami płuc, takimi jak POChP czy astma, przebycie leczenia napromienianiem z powodu raka płuca może zmniejszyć wydolność oddechową. Jest to powikłanie wywołane ograniczonym zwłóknieniem tkanki płuca. Chorzy tacy mogą wymagać opieki pulmonologicznej i rehabilitacji oddechowej.
Opracowanie: Justyna Wilczyńska, WWCOiT im.M.Kopernika w Łodzi

 Radioterapia raka płuca - poradnik pacjenta [PDF]
Radioterapia raka płuca - poradnik pacjenta [PDF]